Technologie pro recyklaci vody
Charakteristika technologie
- Typ procesu
- Fyzikálně chemické procesy
- Skupina technologií
- Oxidačně redukční procesy
- Název procesu
- Chemické pokročilé oxidační procesy
- Popis technologie
Většina fyzikálně chemických procesů čištění vstupních vod je ze své podstaty pouze separačních. Jednou z cest, jak docílit transformace, případně částečné či úplné destrukce polutantů, je aplikace silných oxidačních činidel.
Oxidovat lze i některé anorganické sloučeniny, např. kyanidy na kyanatany, případně až na CO2 a N2, nebo sulfidy na elementární síru či sírany.
Nicméně většina oxidačních procesů cílí spíše na organické polutanty, které jsou oxidovány na látky jednodušší, méně toxické, lépe biologicky rozložitelné, v ideálním případě až na CO2 a H2O.
Specifickou skupinou jsou tzv. pokročilé oxidační procesy (Advanced Oxidation Processes AOPs) jejichž společným jmenovatelem je průběh za běžných teplot a tlaků. Většina AOPs je založena na generování hydroxylových radikálů, které jsou vlastním oxidačním činidlem. Tyto radikály jednak patří k nejsilnějším oxidantům (jejich standardní ORP 2,8 V je vyšší než u ostatních běžně dostupných oxidačních činidel s výjimkou fluoru), jednak vykazují malou selektivitu – jsou schopné oxidovat široké spektrum sloučenin.
AOPs lze rozdělit do dvou velkých skupin: procesy chemické a procesy fotochemické.
V případě chemických AOPs jsou radikály generovány použitím běžných oxidačních činidel (nejčastěji O3 a H2O2) za specifických podmínek (vhodná oblast pH, použití katalyzátoru, působení ultrazvuku, ...)
- Aktuálnost
ve vývoji
- Vhodné pro srážkové vody
- Ano, pro odstranění nízkých koncentrací kontaminantů.
- Typické reaktory a jejich uspořádání
Reaktor a celkové uspořádání procesu závisí na konkrétním zvoleném procesu. Obecně v úvahu přicházejí především následující procesy:
Fentonova reakce
Radikály vznikají rozkladem H2O2 katalyzovaným železnatými ionty v kyselém prostředí. Existují modifikace využívající jiný zdroj železa (železité ionty, elementární železo), nebo generující katalyzátor nebo samotný peroxid elektrochemicky přímo ve vodě.
Ozonizace v alkalickém prostředí
V alkalických podmínkách (pH > 9) u ozonu převažuje tzv. nepřímá oxidace prostřednictví hydroxylových radikálů.Katalyzovaná ozonizace
Vznik radikálů při ozonizaci lze mimo alkalickou oblast vyvolat pomocí katalyzátoru.O3/H2O2
Hydroxylové radikály vznikají i vzájemnou reakcí ozonu a peroxidu.Elektrochemická oxidace
U těchto procesů probíhají oxidační (a redukční) procesy na elektrodách, mezi kterými protéká vstupní voda. I v tomto případě jsou oxidační procesy (odehrávající se na anodě) připisovány především vzniku radikálů.Sonolýza
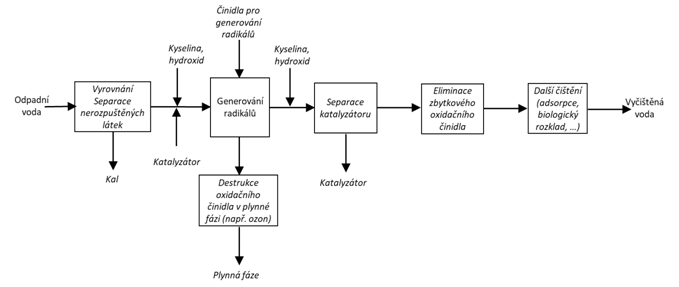
I použití ultrazvuku (buď samotného, nebo v kombinaci s dalšími činidly) může vést ke vzniku radikálů a k oxidačním procesům.- Typické schéma
Vstupní proud
- Cílené znečištění
Především organické rozpuštěné látky, které jsou toxické a/nebo obtížně biologicky rozložitelné.
V případě hygienického zabezpečení jsou cílovým znečištěním mikroorganismy.
- Typické koncentrace cílového znečištění
V širokém rozmezí obvykle od jednotek po stovky mg/l, v některých případech i vyšší. Aplikace na vyšší koncentrace obvykle předpokládá následné biologické dočištění, ale řadu chemických AOPs lze použít i pro eliminaci koncentrací příliš nízkých pro biologické čištění.
- Kritické parametry
Dávka oxidačního činidla: Většinou rozhodující z hlediska ekonomické proveditelnosti. Hydroxylové radikály nejsou selektivní a mohou být spotřebovávány i na vedlejší reakce.
Potenciál procesu pro tvorbu nežádoucích (toxických) vedlejších produktů: Produkty částečného rozkladu některých látek mohou být rizikovější než původní polutant.
- Inhibiční vlivy
Přítomnost zhášečů radikálů: Některé látky, označované jako zhášeče (radical scavenger), eliminují vzniklé radikály a zvyšují spotřebu činidel a snižují účinnost procesu. Jde například o uhličitany nebo hydrogenuhličitany.
- Další relevantní parametry
Stejně jako u klasické oxidace je průběh a účinnost AOPs ovlivňována reakční dobou, teplotou, tlakem, v některých případech hodnotou pH a celkovým složením vstupní vody. Před návrhem konkrétní technologie je nutné provést testy pro ověření použitelnosti a získání dat pro optimalizaci procesu, včetně zjištění dávky oxidačního činidla, případně množství vynaložené energie.
Výstupní proud
- Dosažitelné koncentrace cílového znečištění
Silně závislé na charakteru vstupní vody a typu procesu. Zejména u oxidace organických látek nelze předpokládat stoprocentní degradaci. Značný rozdíl může být mezi účinností odstranění konkrétní organické látky a celkovým odstraněním organických sloučenin (ChSK , TOC).
- Hygienizační funkce
Je možná, ale záleží na složení vstupní vody a dávce činidla.
Implementace
- Investiční náklady
Silně variabilní podle zvoleného oxidačního procesu a charakteru a množství vstupní vody.
- Prostorová náročnost
Odvíjí se zcela od množství čištěných vod a zvoleného typu oxidačního procesu.
- Bezpečnostní rizika
Práce s látkami, které mají toxické a/nebo korozivní účinky.
Provoz
- Energetická náročnost
Liší se podle typu činidla. V případě ozonu nebo ultrazvuku je potřeba počítat se zvýšenou spotřebou el. energie.
- Náročnost na obsluhu
Porozumění principům daného procesu, pochopení faktorů, které ho ovlivňují a znalost možných rizik a problémů jsou naprosto nezbytné.
- Provozní náklady
Odvíjí se především od zdroje radikálů, případně pomocných chemikálií.
- Chemikálie
Podle typu procesu H2O2, O3, katalyzátor
Pomocné chemikálie, např. kyseliny a zásady pro úpravu pH, případně redukční činidla (siřičitan, thiosíran) pro eliminaci zbytkových koncentrací oxidačního činidla.
- Měření a regulace
průtok, dávka činidel, pH, ORP , teplota, zbytková koncentrace oxidantu na výstupu
Produkce odpadů
- Plynné
V případě aplikace ozonu je nutné zajistit eliminaci zbytkového plynného ozonu na výstupu z reaktoru.
- Pevné
Oxidační procesy mohou někdy vést k tvorbě sraženiny, kterou je nutné oddělit a zpracovat.
V případě Fentonovy reakce je železnatý katalyzátor odstraněn vysrážením.
Kombinace s dalšími procesy
- Vyžadovaná předúprava
Obvykle separace nerozpuštěných látek.
- Vyžadované dočištění
Někdy je nezbytností odstranění zbytkových koncentrací oxidačního činidla. Např. přídavkem vhodného redukčního činidla.
V případě oxidace organických látek jsou často konečným produktem jednodušší, snáze rozložitelné látky. Pak je nutné biologické dočištění.
Další alternativou může být odstranění nízkých koncentrací reziduálních látek adsorpcí.
- Typická průmyslová odvětví
- Chemický průmysl Farmaceutický průmysl Textilní průmysl
Literatura
Kabdasli, I. and O. Tunay (2010). Chemical Oxidation Applications for Industrial Wastewaters, IWA Publishing.
Tchobanoglous, G., et al. (2014). Wastewater engineering: treatment and resource recovery. New York, NY, McGraw-Hill Education.
Parsons, S. (2004). Advanced oxidation processes for water and wastewater treatment. London, IWA.
Rao, D. G. (2013). Wastewater treatment: advanced processes and technologies. London, IWA Publishing.
Vytvořeno za podpory

Tento katalog byl vytvořen se státní podporou Technologické agentury ČR v rámci Programu Beta 2.
www.tacr.cz
Ministerstvo průmyslu a obchodu
www.mpo.cz
Vysoká škola chemicko-technologická v Praze
www.vscht.cz
Vysoká škola chemicko-technologická v Praze
tvp.vscht.cz